Neue austauschbare Bioidenticals
Hinweis
Es handelt sich bei dem Inhalt dieser Seite um eine frühere Veröffentlichung. Bitte beachten Sie, dass die Aussagen gegebenenfalls nicht mehr der aktuellen Rechts- und Vertragslage entsprechen.
Bei Fragen hilft Ihnen das DAP-Team auch gerne persönlich weiter – schreiben Sie einfach eine E-Mail an insonderfo@anderesdeutschesapothekenportal.de.
Zum 1. Juni 2021 wurden zwei neue Bioidenticals mit dem Wirkstoff Bevacizumab in Anlage 1 zum Rahmenvertrag nach § 129 Abs. 2 SGB V aufgenommen. In Anlage 1 wird definiert, welche biotechnologisch hergestellten Arzneimittel im Rahmen der Aut-idem-Regelung in der Apotheke austauschbar sind (sog. Bioidenticals).
Mit Wirkung zum 1. Juni 2021 wurden die Arzneimittel Alymsys (Servier) und Oyavas (STADA) in Anlage 1 zum Rahmenvertrag aufgenommen. Beide enthalten den Wirkstoff Bevacizumab und werden von GH Genhelix hergestellt. Als Bioidenticals können sie nun aut idem ausgetauscht werden, sofern dem Austausch keine Bedenken entgegenstehen und die Verordnung nicht mit Aut-idem-Kreuz ausgestellt wurde. Die Präparate fallen damit unter die Regelungen des Marktes preisgünstiger Arzneimittel nach § 12 Abs. 1 Rahmenvertrag (vorrangige Abgabe eines Rabattarzneimittels; wenn kein Rabattarzneimittel verfügbar: Abgabe eines der vier preisgünstigsten Arzneimittel).
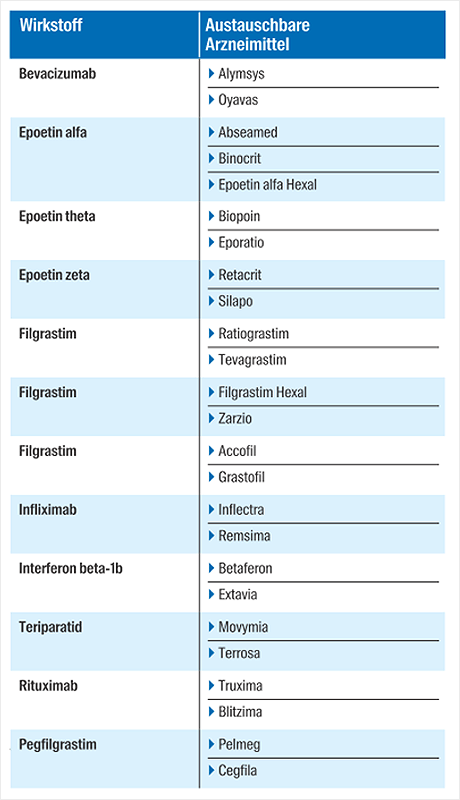
Aktuell sind diese Bioidenticals in Anlage 1 gelistet (Stand: 01.06.2021):
Die beiden Bioidenticals sind nun auch in Anlage 3 Teil 2 Anhang 2 der Hilfstaxe (Gruppe mit Fertigarzneimitteln mit Bevacizumab) gelistet.
Kein Aut-idem-Austausch bei den anderen Bevacizumab-Präparaten
Das Original-Biologikum (Referenzpräparat) Avastin und die anderen Bevacizumab-Biosimilars (Aybintio, MVASI und Zirabev) sind jeweils nicht untereinander austauschbar, auch nicht durch Alymsys oder Oyavas. Obwohl sie denselben Wirkstoff enthalten, unterscheiden sie sich dennoch in ihren Herstellungsverfahren. Somit darf bei einer Verordnung über Avastin beispielsweise nur das Original oder ein zugehöriger Import abgegeben werden. Gleiches gilt für alle anderen Biosimilars (mit Ausnahme von Alymsys und Oyavas): Auch hier steht jeweils nur das Original oder ein zugehöriger Import zur Abgabe zur Verfügung.
Hintergrund
Biotechnologisch hergestellte Arzneimittel dürfen in der Apotheke nur dann aut idem substituiert werden, wenn sie in Anlage 1 gelistet sind. Geregelt ist dies in § 9 Abs. 3 Rahmenvertrag. Bei allen anderen Biologika ist eine Aut-idem-Substitution nicht zulässig und nur ein Austausch zwischen Original- und Importarzneimitteln erlaubt. Bioidenticals sind biotechnologisch hergestellte Arzneimittel, die aus derselben Produktionsstätte stammen und daher identisch und damit auch untereinander austauschbar sind. Es muss allerdings berücksichtigt werden, ob ein Unterschied hinsichtlich Handhabung und Applikation besteht.

