CHMP: Zulassungsempfehlung für Zilucoplan bei Erwachsenen mit generalisierter Myasthenia gravis
Hinweis
Es handelt sich bei dem Inhalt dieser Seite um eine frühere Veröffentlichung. Bitte beachten Sie, dass die Aussagen gegebenenfalls nicht mehr der aktuellen Rechts- und Vertragslage entsprechen.
Bei Fragen hilft Ihnen das DAP-Team auch gerne persönlich weiter – schreiben Sie einfach eine E-Mail an insonderfo@anderesdeutschesapothekenportal.de.
Der Ausschuss für Humanarzneimittel (CHMP) der EMA empfiehlt die Zulassung von Zilbrysq® (Zilucoplan) für Erwachsene mit Myasthenia gravis, die Acetylcholinrezeptor-Antikörper aufweisen. Grund für die Entscheidung sind positive Daten bezüglich Wirksamkeit und Sicherheit aus Phase-II- und Phase-III-Studien.
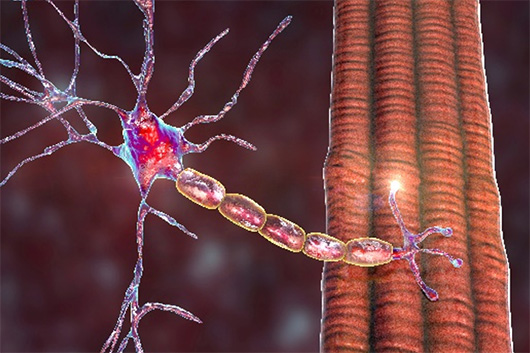
Die generalisierte Myasthenia gravis ist zum Großteil auf die Bildung von Antikörpern gegen nikotinerge ACh-Rezeptoren zurückzuführen, die vor allem auf der motorischen Endplatte der Skelettmuskulatur vorkommen. Durch die Antikörpermarkierung kommt es zur Aktivierung des Komplementsystems mit anschließender Zerstörung der Postsynapse. Klinisch führt dies zu Muskelschwäche und belastungsabhängigen Paresen an verschiedenen Stellen des Körpers.
Neben der Thymektomie und der immunsuppressiven Therapie stehen auch C5-Komplementinhibitoren wie Ravulizumab oder Eculizumab zur Verfügung. Mit Zilucoplan könnte demnächst ein weiterer C5-Inhibtor mit einem guten Sicherheitsprofil verfügbar sein.
In verschiedenen Studien konnte gezeigt werden, dass Zilucoplan eine Verbesserung des Schweregrades der Erkrankung sowie der Funktionswerte und Lebensqualität (gemessen anhand spezifischer Myasthenia-gravis-Scores) im Vergleich zu Placebo erreichen kann. Zudem erwies sich das Medikament als gut verträglich, mit Blutungen an der Injektionsstelle als häufigste Nebenwirkung.
Der Vorteil gegenüber bisherigen C5-Inhibitoren: Zilucoplan kann vom Patienten selbst subkutan injiziert werden.1
1 European Medicines Agency: Zilbrysq. Online verfügbar unter:
https://www.ema.europa.eu/en/medicines/human/summaries-opinion/zilbrysq